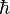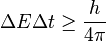Física moderna
Principio de incertidumbre de Heisenberg
Definición formal
Si se preparan varias copias idénticas de un sistema en un estado determinado, las medidas de posición y momento (masa x velocidad) de las partículas constituyentes variarán de acuerdo a una cierta distribución de probabilidad característica del estado cuántico del sistema. Las medidas de la desviación estándar Δx de la posición y el momento Δp verifican entonces el principio de incertidumbre que se expresa matemáticamente como:
En la física de sistemas clásicos esta incertidumbre de la posición-momento no se manifiesta puesto que se aplica a estados cuánticos y hes extremadamente pequeño. Una de las formas alternativas del principio de incertidumbre más conocida es la incertidumbre tiempo-energía que puede escribirse como:
Esta forma es la que se utiliza en mecánica cuántica para explorar las consecuencias de la formación de partículas virtuales, utilizadas para estudiar los estados intermedios de una interacción. Esta forma del principio de incertidumbre es también la utilizada para estudiar el concepto de energía del vacío.
Explicación cualitativa
En física clásica, consideramos que tenemos un sistema completamente caracterizado si conocemos las posiciones y el momento de todas sus partículas en un instante dado. Al analizar un sistema que constara de un sólo electrón Heisenberg encontró que para tratar de determinar la posición con exactitud se necesitarían fotones de alta frecuencia, que al interaccionar con el electrón alterarían significativamente su velocidad.En general, cuando un sistema es lo suficientemente pequeño, no existen métodos físicamente posibles de observarlo sin alterar considerablemente su estado.
Volviendo sobre el ejemplo anterior, para que un fotón incida sobre una partícula deberá tener una longitud de onda máxima igual al diámetro de esa partícula (en caso contrario la partícula resulta transparente al fotón) para poder interaccionar. Sabemos que la energía de un fotón es inversamente proporcional a su longitud de onda, en concreto:
E = h c / λ
El Principio cuantifica la máxima precisión que podemos esperar obtener de una observación: el error total en nuestras medidas simultáneas de dos variables conjugadas será siempre como mínimo igual a la constante de Planck dividida por un factor de 4Π. Recordemos que la constante de Planck, de manera muy significativa, corresponde al cuanto de acción, esto es, la acción mínima que se puede ejercer sobre un sistema.
Consecuencias del principio
Este principio supone un cambio básico en nuestra forma de estudiar la Naturaleza, ya que se pasa de un conocimiento teóricamente exacto (o al menos, que en teoría podría llegar a ser exacto con el tiempo) a un conocimiento basado sólo en probabilidades y en la imposibilidad teórica de superar nunca un cierto nivel de error.El principio de indeterminación es un resultado teórico entre magnitudes conjugadas (posición - momento, energía-tiempo, etcétera). Un error muy común es decir que el principio de incertidumbre impide conocer con infinita precisión la posición de una partícula o su cantidad de movimiento.
Es decir, nada impide que midamos con precisión infinita la posición de una partícula, pero al hacerlo tenemos infinita incertidumbre sobre su momento. Por ejemplo, podemos hacer un montaje como el del experimento de Young y justo a la salida de las rendijas colocamos una pantalla fosforescente de modo que al impactar la partícula se marca su posición con un puntito. Esto se puede hacer, pero hemos perdido toda la información relativa a la velocidad de dicha partícula.